Лабораторная работа № 6. Коррозия металлов и сплавов и методы защиты металлов от коррозии.
1.Цель работы: изучение влияния некоторых факторов на протекание электрохимической коррозии и изучить методы защиты металлов от коррозии.
2. Рабочее задание:
1) проделать лабораторную работу
2) ответить на контрольные вопросы
3. Основные понятия.
Коррозия — это процесс самопроизвольного разрушения (окисления) металлов под химическим и электрохимическим воздействием окружающей среды. По механическому протеканию коррозионные процессы могут быть разбиты на две группы: химические и электрохимические. Химическая коррозия протекает в сухих газах, жидкостях, не обладающих заметной электропроводностью. Это обычная химическая, гетерогенная, окислительно-восстановительная реакция. Например, при высокой температуре происходит коррозия Fе:
Электрохимическая коррозия происходит в электролитах и сопровождается образованием электрического тока.
Электрохимическое растворение металла — сложный процесс, состоящий из трех основных :
1. анодного процесса — процесса перехода ионов металла в раствор, появления гидразированных ионов металла в электролите и некомпенсированных электронов на анодных участках.
Этот процесс происходит на более электроотрицательных участках поверхности;
2. процесса перетекания электронов по металлу от анодных участков к катодным и соответствующего перемещения катионов и анионов в растворе;
3.Катодного процесса – ассимиляции (усвоения) электронов какими-либо окислителями ионами или молекулами раствора, способными к восстановлению на поверхности катода (они называются деполяризаторами (Д)). Катодный процесс происходит на более электроположительных участках поверхности.
Наиболее распространенные в природе окислители – деполяризаторы – ион водорода H + и молекулярный О2, растворенный в электролите. В зависимости от характера среды катодные процессы протекают следующим образом:
в нейтральной среде:
Т.о. электрохимическая коррозия на неоднородной поверхности металла аналогична работе короткозамкнутого гальванического элемента. Разность потенциалов анодного и катодного участков, которая обуславливает появление тока в коррозионном элементе, связана не только с различием металлов, образующих этот элемент. Это различие может быть связано с состоянием металла (например, различные обработки поверхности, микроструктура и т.д.) и с составом электролита (разные концентрации солей, концентрация кислорода, скорость движения, коррозионной среды и др.).
3. Защита металлов от коррозии.
Самым оптимальным решением проблемы защиты металлов от коррозии была бы полная замена металлов, подверженных коррозии, на коррозионно-устойчивые металлы, сплавы, полимерные материалы. В настоящее время такие материалы применяются выпускаются, но они или дороги, или по своим физико-механическим свойствам не удовлетворяют всем требованиям промышленности. Поэтому, не смотря на широкое применение полимерных материалов, основными конструкционными материалами являются металлы. Методы защиты от коррозии основаны на следующих принципах:
1. Изоляция металла от воздействия внешней агрессивной среды.
Это осуществляется за счет следующих мероприятий:
— покрытия металла поверхностными пассивирующими пленками из его нерастворимых соединений, которые образуются при фосфатировании, оксидировании, азотировании и т.д.;
— создание защитных покрытий из слоев смазки, битумов, красок, эмалей:
— нанесение покрытий из других металлов.
По способу защитного действия и электрохимическим свойствам покрытия металлами делятся на катодные и анодные.
Анодное покрытие – электронный потенциал металл анодного покрытия в данной среде меньше потенциала защищаемого металла. В качестве анодного покрытия для стали используют цинк, кадмий и др. При нарушении целостности покрытия разрушается само покрытие.
Анодные покрытия защищаю главным образом электрохимически, поэтому степень пористости анодного покрытия не играет существенного значения пример растворения цинкового покрытия на железе.


Анод: Zn°-2е→
Катод: 2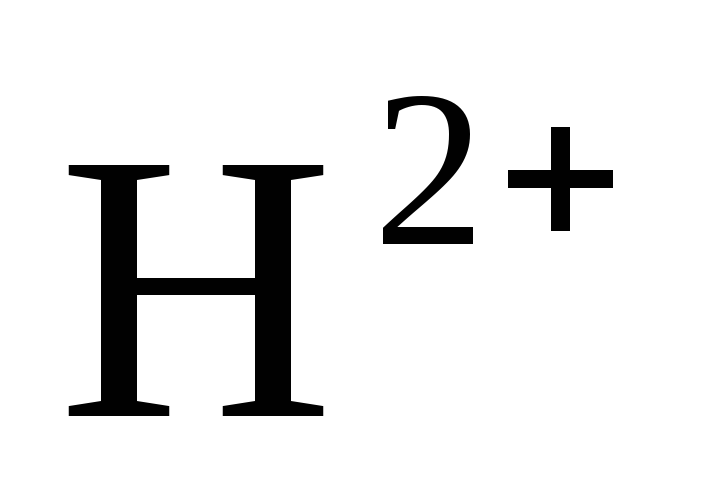 +2е→
+2е→
Z n +2
n +2 =
=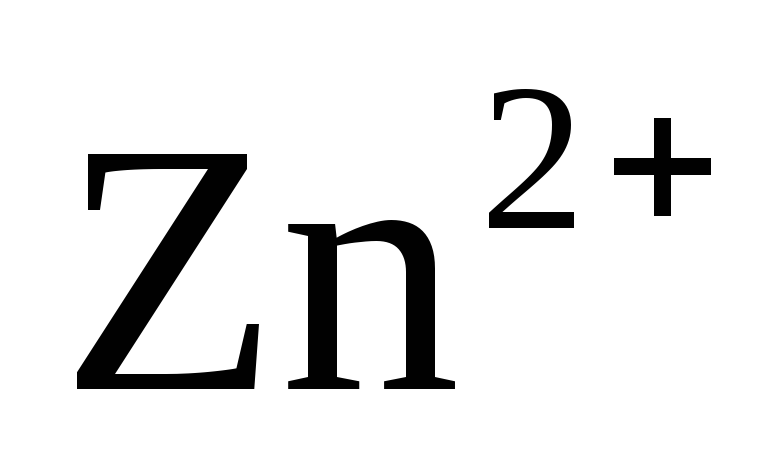 +
+
Если pH>=7(например, морская вода), то окислителем является кислород и происходят следующие процессы:
А нод:Zn°-2е→
нод:Zn°-2е→ 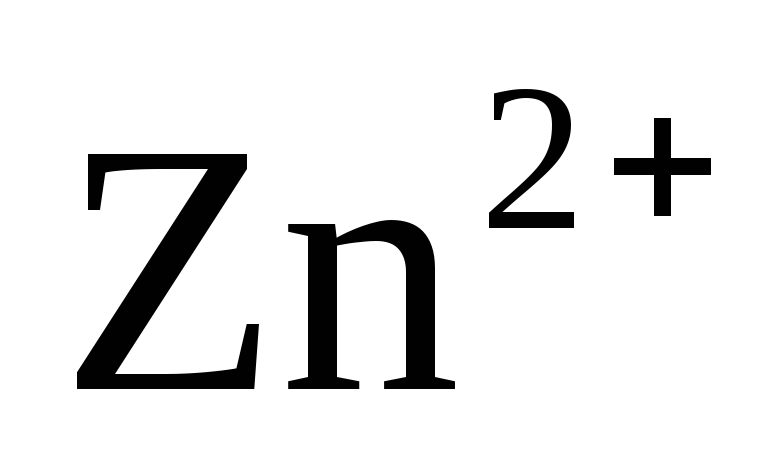 2
2
Катод:  О2+2Н2О+4е→4ОН
О2+2Н2О+4е→4ОН 1
1
2 Zn + О2+2Н2О = 2
Zn + О2+2Н2О = 2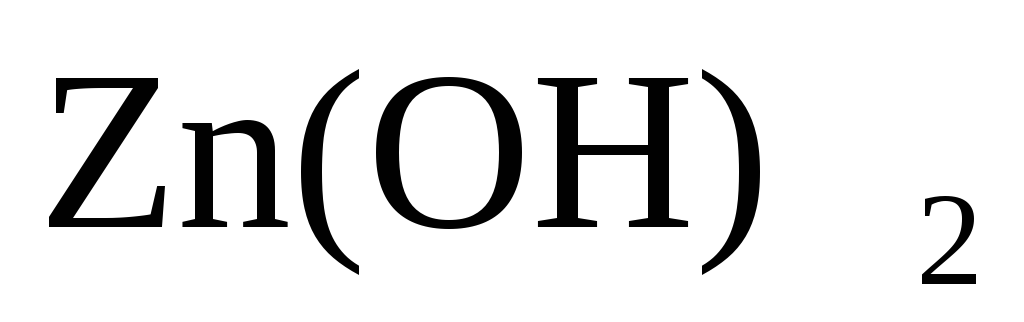
Анодное покрытие защищает металл до тех пор, пока не будет разрушен практически весь слой цинка.
Катодное покрытие – электронный потенциал металлопокрытия  больше потенциала защищаемого металла
больше потенциала защищаемого металла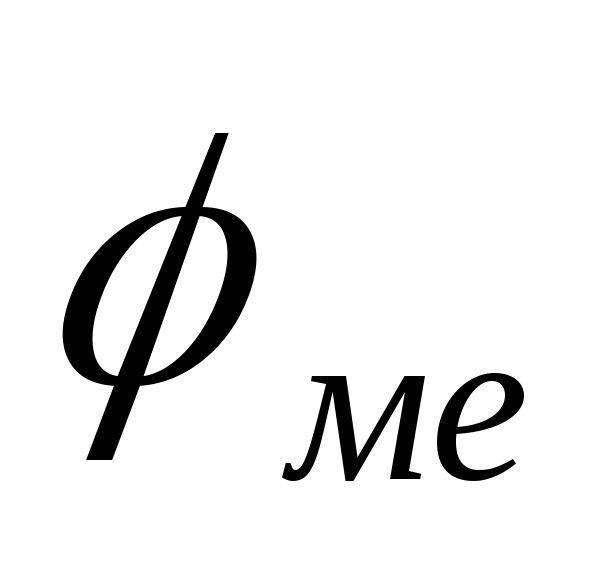 (
(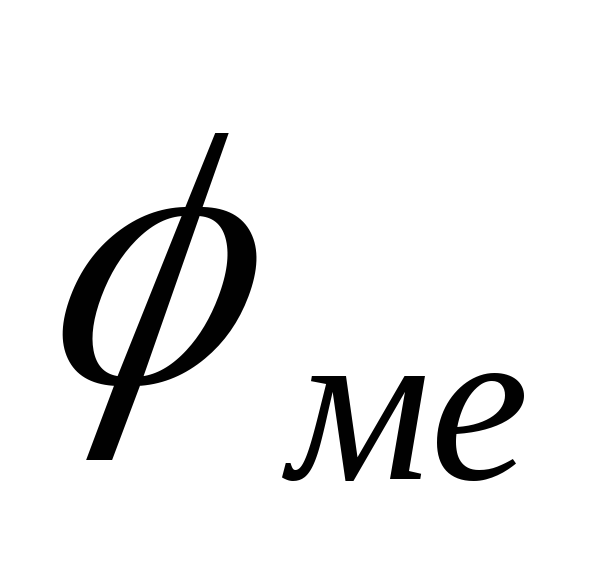 ).
).
К катодным покрытиям относятся лужение, меднение, никелирование и др. Рассмотрим случай покрытия железа оловом.
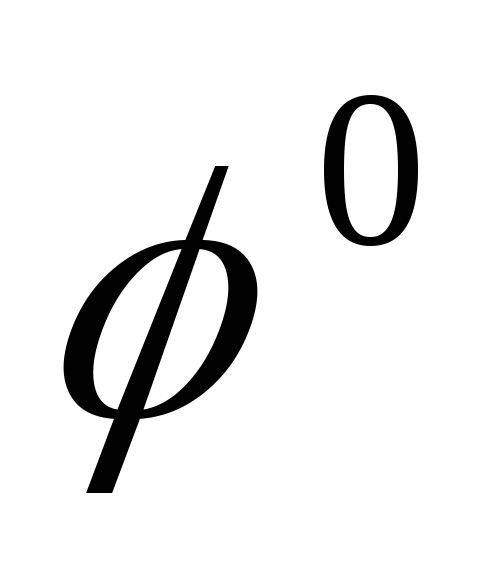 Sn/
Sn/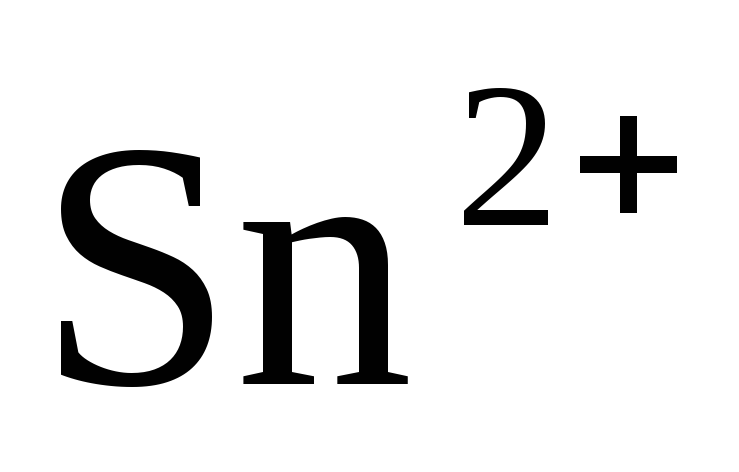 = -0.136В
= -0.136В
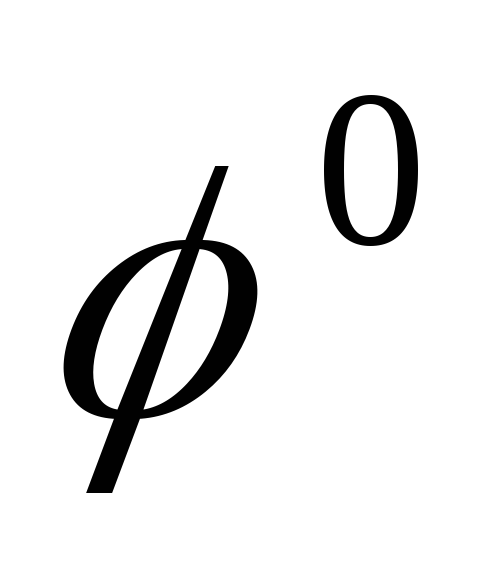 Fe/
Fe/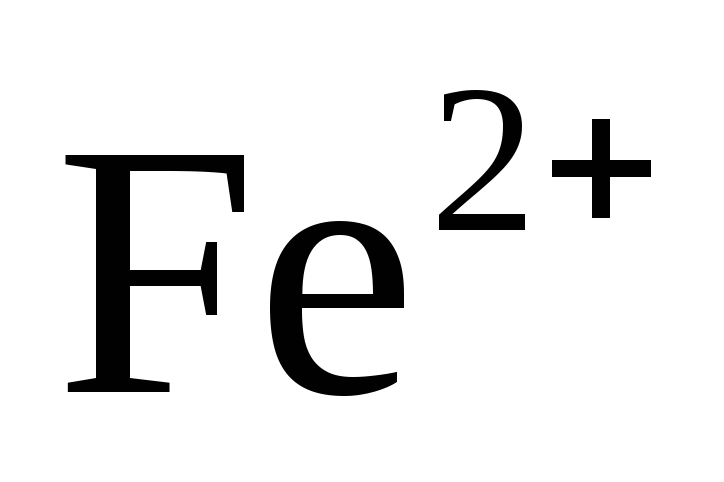 = -0.44В
= -0.44В
В возникшем гальваническом элементе протекают реакции:

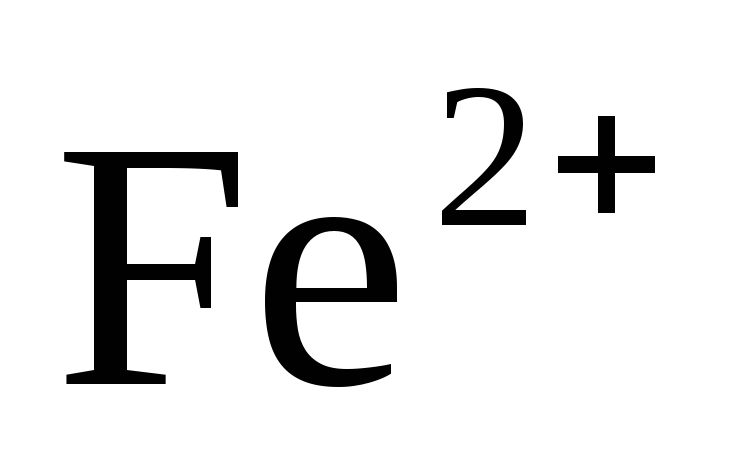
Анод: Fe°-2е→
К атод:
атод: О2+2Н2О+4е→4ОН
О2+2Н2О+4е→4ОН 

2Fe + О2+2Н2О = 2
Под действием кислорода и воды далее протекает реакция:

4+ О2+Н2О↔4
При катодном покрытии металл предохраняется до тех пор, пока не нарушена сплошность покрытия, а при её нарушении основной металл разрушается более интенсивно, чем без защиты, при этом создаётся благоприятные условия для язвенной коррозии. На практике чаще применяются катодные покрытия, т.к. во многих агрессивных средах они имеют значительно меньшую скорость собственной коррозии, чем анодные покрытия.
2. Создание такой электрохимической системы, в которой защищаемая конструкция станет катодом и на ней будет протекать катодный процесс восстановления деполяризатора. К электрохимическим методам защиты относятся катодная, протекторная, анодная защиты. Последняя в судостроении пока не находит применения. Принцип действия протекторной защиты аналогичен действию анодного покрытия. В качестве протектора-“жертвенного анода”, как его называют в иностранной литературе, используются металлы с более электроотрицательным потенциалом, чем у защищаемого металла, чаще всего: алюминий, магний, цинк и их сплавы. Чем больше разность потенциалов в паре “основной металл-протектор”, тем больше защитный эффект. К борту судна, например, присоединяется протектор и образуется гальваническая пара, в которой катодом является металл корпуса судна.
Катодная защита осуществляется с помощью внешнего источника постоянного тока; эта защита основана на использовании основных законов процесса электролиза: защищаемая деталь подключается к отрицательному полюсу источника тока, становится катодом, анодом служит или растворимый, или нерастворимый электрод. Применение растворимого анода (чугун, сталь и др.) приводит к окислению его. При использовании нерастворимого анода на нем протекает процесс окисления воды:
Для катодной защиты корпуса корабля применение растворимых анодов не эффективно, так как процесс их замены — громоздкая и дорогая операция. Поэтому в судостроении применяются нерастворимые аноды, имеющие титановое основание, платиновую фольгу, и экран из стеклопластика.
3. Снижение агрессивности среды за счет введения ингибиторов, т.е. веществ, замедляющих, тормозящих катодный и анодный процессы.
В качестве ингибиторов коррозии применяются неорганические вещества, тормозящее действие которых, как полагают, связано с окислением» поверхности металла (нитраты, хроматы) или с образованием пленки нерастворимого соединения металла с данным ионом и, возможно, кислородом (фосфаты, гидрофосфаты). Неорганические ингибиторы тормозят преимущественно анодную реакцию.
В качестве ингибиторов широко применяются также органические вещества, содержащие амино-, тио-, карбоксо-гругшы и некоторые другие. Защитное действие органических ингибиторов связано с их адсорбцией на поверхности металла: В результате адсорбции наблюдается торможение анодного и катодного процессов и снижение скорости коррозии. Необходимо отметить, что наиболее эффективны комбинированные методы защиты. Такие методы сочетают в себе одновременное применение различных способов защиты:
-покрытие металлами + окраска;
-окраска + катодная защита;
-окраска + протекторная защита;
-окраска с введением в краситель ингибитора.
Суммарный эффект комбинированной защиты часто выше арифметической суммы эффектов отдельных способов.




