Общие свойства металлов
Металлы отличаются от неметаллов перечнем свойств, о которых ниже и пойдёт речь.
В настоящее время известно 118 химических элементов, из которых 92 являются металлами.
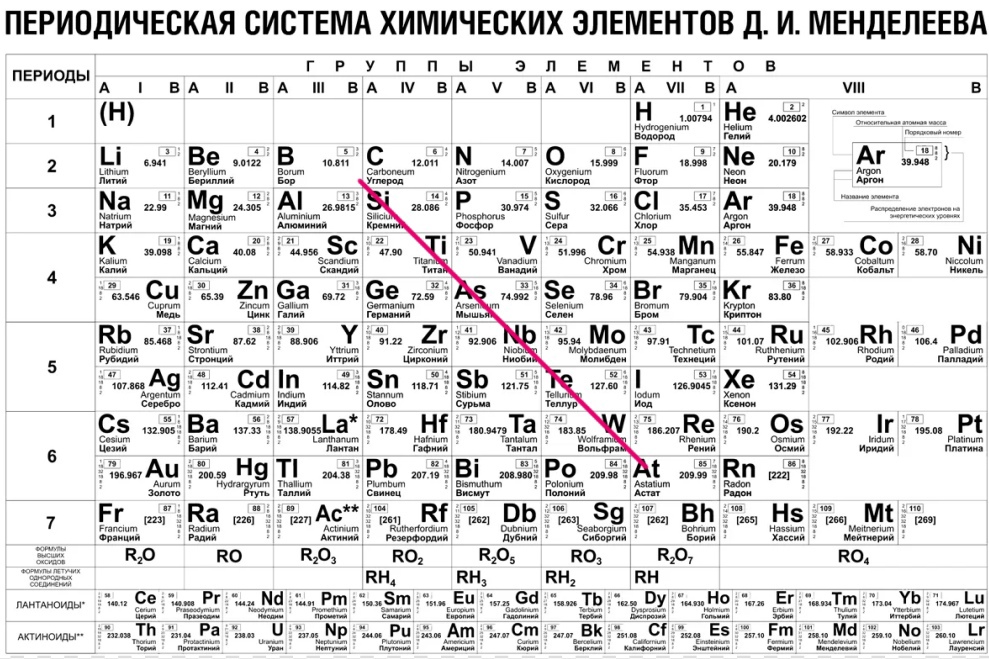
В короткой Периодической таблице металлы находятся в начале периодов, а также в побочных подгруппах. Все элементы побочных подгрупп являются металлами. Условной границей, отделяющей металлы от неметаллов, служит диагональ бор — астат, левее и ниже которой все элементы относятся к металлам. Элементы, находящиеся вблизи диагонали, имеют двойственную природу.
Строение кристаллической решётки металлов
Для металлов и их сплавов характерна металлическая кристаллическая решётка. Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны.
Между атомами в составе кристаллической решётки возникает металлическая химическая связь.

Сравнивая энергию различных типов химических связей, можно сделать вывод о прочности металлической связи:
| для молекулярной связи | 103 Дж/моль |
| для ионной | 105–107 Дж/моль |
| для металлической | 105–106 Дж/моль |
Чем больше энергия, тем связь прочнее → металлическая является одной из самых прочных. Это обуславливает некоторые физические и химические свойства металлов.
Строение электронных оболочек металлов
У металлов сравнительно большие радиусы атомов. На внешнем электронном слое у большинства металлов находится небольшое число электронов (от 1 до 3). Их наружный слой далёк до завершения. Металлам характерны низкие значения электроотрицательности (
Для того, чтобы приобрести электронную конфигурацию ближайшего инертного газа (а все элементы к этому и стремятся), металлам необходимо отдать один или два электрона, в зависимости от периода, в котором находится металл:
Li: [He]2s¹ Ca: [Ar]3s² Al: [Ne]3s²3p¹ Mg: [Ne] 3s 2 K: [Ar] 4s 1 Fe: [Ar] 3d 6 4s 2 Zn: [Ar] 3d 10 4s 2
Внешний энергетический уровень металла обуславливает его окислительно-восстановительные свойства, как и то, какую степень окисления металл способен принимать. Например, Li ⁺¹ Ca⁺² Al⁺ 3
Физические свойства металлов
1. Отсутствие цвета и характерный металлический блеск. Это объясняется высокой подвижностью электронов, имеющих разную скорость и энергию → электроны способны поглощать всю линию спектра (не окрашены). При снятии возбуждения электрона происходит излучение света (блеск).
2. Металлы обладают высокой электропроводностью и теплопроводностью. Это хорошо объясняется высокой подвижностью электронов, находящихся в составе металлической кристаллической решётки.
3. Вследствие большой прочности металлической связи металлы обладают высокими температурами плавления и значительной твёрдостью. (В металлах с низкой валентностью прочность связи ниже → эти металлы легкоплавкие и мягкие. Например, литий.)
4. Пластичность. Благодаря особенностям кристаллической решётки металлы в результате механического воздействия способны не разрушаться, образуя порошок, а менять форму.
5. Магнетизм. Создается неравномерным распределением электронов в атомах некоторых металлических элементов. Неравномерное вращение и движение, вызванное этим неравномерным распределением электронов, перемещает заряд внутри атома вперед и назад, создавая магнитные диполи.
Химические свойства металлов
Благодаря тому, что металлам проще лишиться электронов на своём внешнем энергетическом слое, в реакциях металлы-простые вещества будут выступать исключительно в роли восстановителей.
В зависимости от активности, металлы традиционно подразделяют на три группы: Li, K, Ba, Sr, Ca, Na, Mg, Al – активные металлы; Mn, Zn, Cr, Cd, Co, Ni, Pb – металлы средней активности; H2, Cu, Ag, Hg, Au, Pt – малоактивные металлы.
Чем активнее металл, тем проще он будет отдавать электроны → будет проявлять более сильные восстановительные свойства и первым взаимодействовать с окислителем.

4Li + O2 → 2Li2O (оксид)
2Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (надпероксид)
с водой
C жидкой водой взаимодействуют активные металлы. Результатом этой ОВР является образование щелочей.
2Na + H2O → 2NaOH + H2
Cu + H2O ↛
Металлы правее водорода (не активные) не вступают в реакцию с водой.
с растворами кислот
Те металлы, которые стоят в ряду активности левее водорода, способны вытеснять его, образуя с кислотным остатком соль.
Zn + 2HCl → ZnCl2 + H2
3Fe + 4H3PO4 → Fe3(PO4)4 + 6H2
Кислоты HNO3 и H2SO4 являются сильными окислителями за счет кислотного остатка и с металлами будут реагировать специфичнее (например, окислять неактивные металлы).
с кислотами-окислителями
В разбавленном виде серная кислота является окислителем за счёт протона.
Продукты восстановления серной кислоты зависят от активности металла, с которым она реагирует.
+ активный Me (Li-Zn) → Соль + H2S⁻² + H2O
+ металл средней активности (Cd-Pb) → Соль + S⁰ + H2O
+ неактивный металл (после H2 и Fe) → Соль + S⁺⁴O2 + H2O
Более подробно о реакциях металлов с серной кислотой можно прочитать в статье.
И разбавленные, и концентрированные растворы азотной кислоты являются окислителями за счёт атома N⁺⁵
Концентрированная азотная кислота даёт один продукт, для разбавленной тенденция образования продуктов реакции аналогична серной кислоте.
HNO3(конц) + Me(независимо от активности) → Соль + NO2 + H2O
+ активный Me (Li-Zn) → Соль + N2⁰ + H2O
+ металл средней активности (Fe-Pb) → Соль + N2⁺¹O + H2O
+ неактивный металл (после H2 и Fe) → Соль + N⁺²O + H2O
HNO3(оч разб) + активный Me (Li-Zn) → Соль + N⁻³H4NO3 + H2O
Более подробно о реакциях металлов с азотной кислотой можно прочитать в статье.
с солями
Металлы способны вступать в реакцию с солями, вытесняя менее активный металл и образуя с кислотным остатком новую соль.
Ca + ZnCl2 → CaCl2 + Zn
K + CuI → KI + Cu
с щелочами

Особенностью амфотерных металлов (Be, Al, Zn и др) является их способность взаимодействовать как с кислотами, так и с щелочами с образованием комплексов.
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
Zn + 2NaOH + H2O → Na2[Zn(OH)4] + H2
При нагревании комплексы не образуются.
2Al + 2NaOH + 2H2O → 3H2 + 2NaAlO2 (алюминат натрия)
Be + 2KOH → H2 + 2NaAlO2 (бериллат калия)
Zn + 2KOH → 2H2 + K2ZnO2 (цинкат калия)
Онлайн-учебник по химии
- Строение вещества
- Строение атома
- Химические связи
- Валентность
- Степень окисления
- Кристаллические решетки
- Неорганическая химия
- Классификация неорганических соединений. Правила номенклатуры и тривиальные названия
- Гидролиз солей в водном растворе
- Общие свойства металлов
- Щелочные металлы
- Оксиды и гидроксиды щелочных металлов
- Серная кислота
- Азотная кислота
- Щелочноземельные металлы
- Медь Серебро и их соединения
- Хром и его соединения
- Железо
- Марганец и его соединения
- Водород и кислород
- Галогены
- Халькогены. Сера и селен.
- Азот
- Фосфор
- Углерод и кремний
- Органическая химия
- Основы органической химии
- Классификация органических соединений
- Номенклатура углеводородов
- Алканы. Химические свойства и получение
- Алкены
- Циклоалканы и циклоалкены
- Алкадиены
- Алкины
- Арены
- Номенклатура органических функциональных производных
- Спирты
- Альдегиды
- Кетоны
- Сложные эфиры
- Амины
- Аминокислоты
- 33 задача по химии в ЕГЭ.
- Общая химия
- Типы химических реакций в неорганической химии
- Скорость химической реакции
- Химическое равновесие. Факторы, влияющие на смещение химического равновесия.
- Химическое равновесие. Задачи на реакторы.
- Гидролиз
- Растворимость: теория и задачи 26 и 34
- Химическая технология
- Классическая термодинамика








