Какой металл не относится к щелочным
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns 1 .
Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
- Реакции с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;
4Li + O2 = 2Li2O - натрий образует пероксид;
2Na + O2 = Na2O2 - калий и все нижестоящие металлы — надпероксиды/супероксиды.
K + O2 = KO2
- Реакции с водой
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
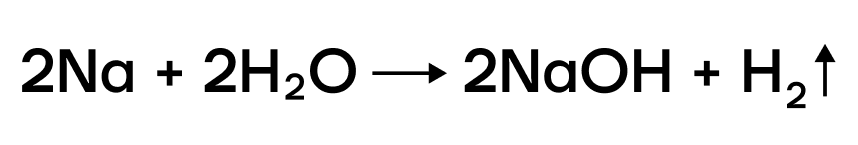
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
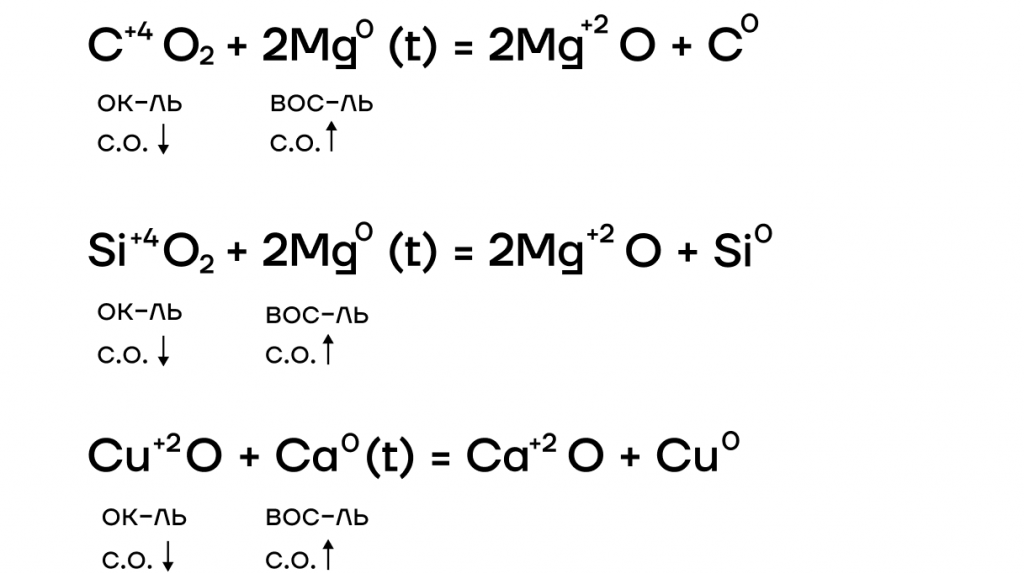
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
Они являются основными оксидами, поэтому:

- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
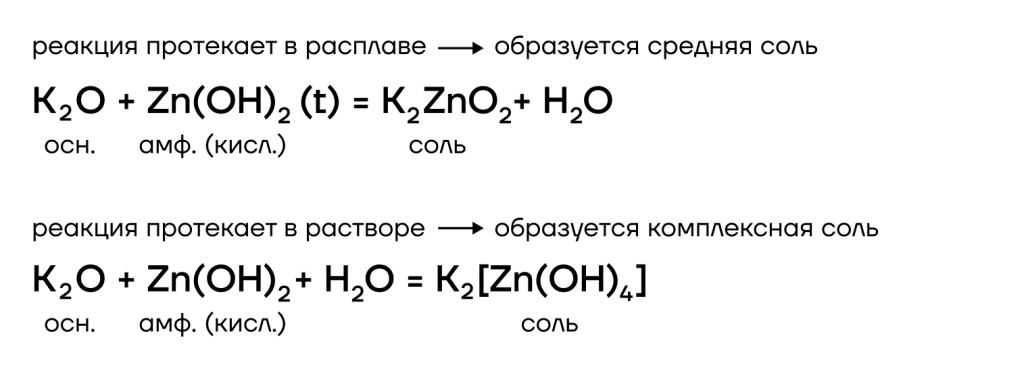
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
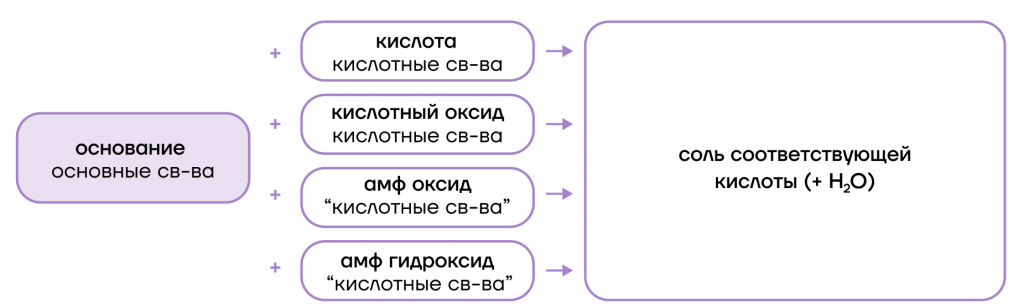
- вступают в реакции ионного обмена с кислотами и солями:
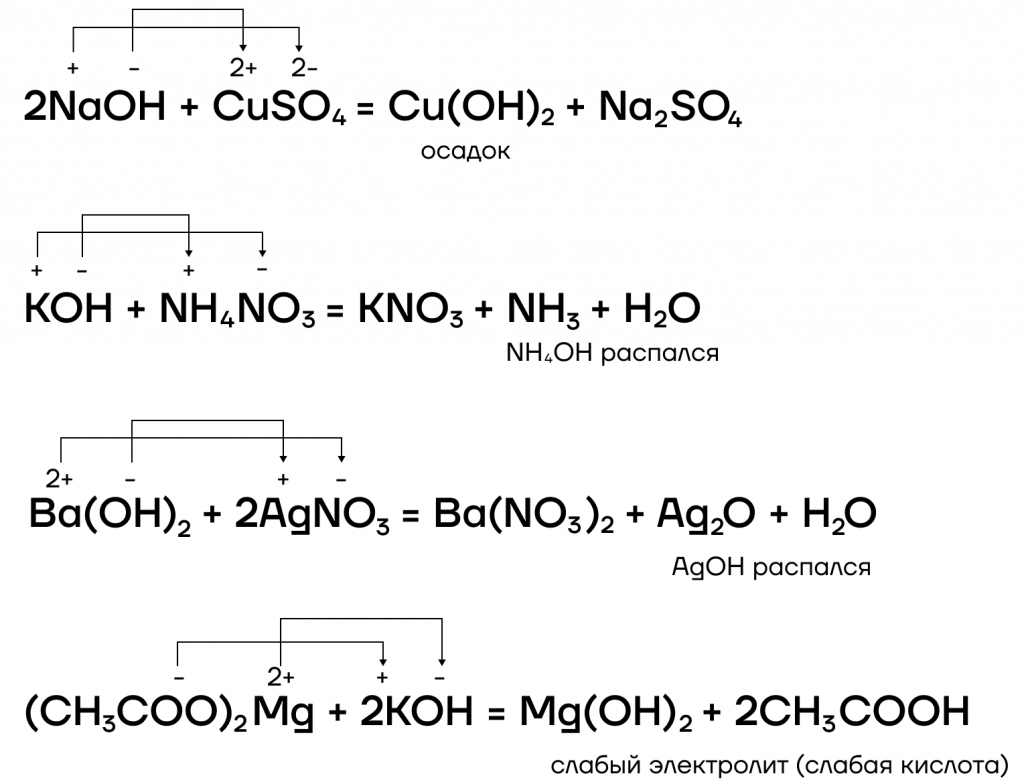
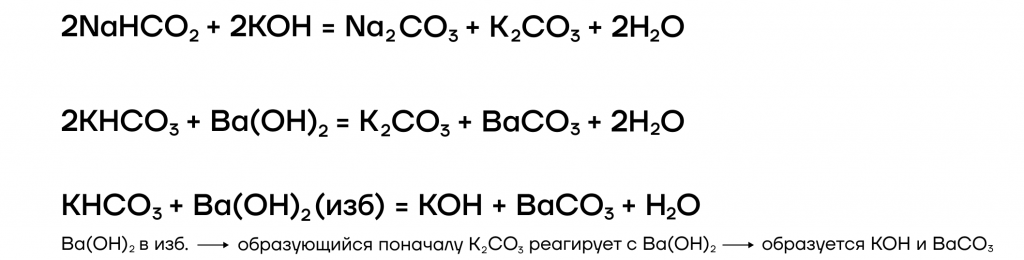
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
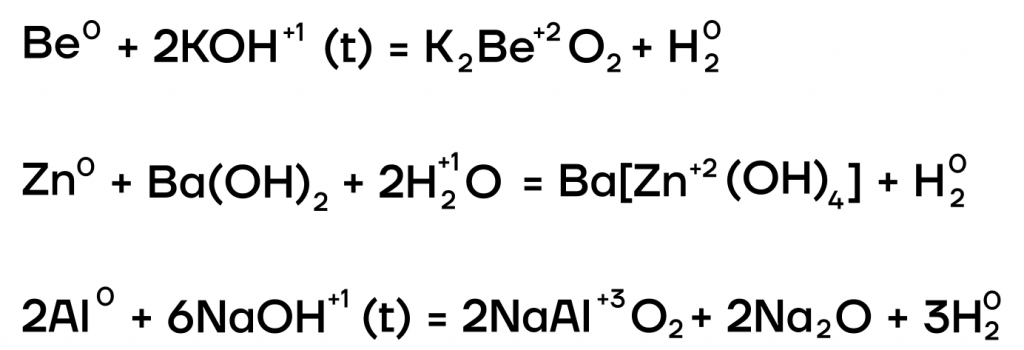
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:

Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
Задание 2.
Щелочные металлы имеют постоянную степень окисления:
Задание 3.
Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.
При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.
При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Щелочи: определение, химические свойства, методы получения
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
Это НЕ основания:
Потому что содержат металл в степени окисления «+1» или «+2»
Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Чем отличаются щёлочи от остальных оснований?
Основания можно разделить на две группы: растворимые и нерастворимые. Растворимые иначе называют щелочами. То есть щелочи – это растворимые основания (растворимые основные гидроксиды).
Таблица 2. – Основания и щёлочи
Место щелочей в классификации гидроксидов
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
Диссоциация слабых оснований
Fe(OH)2 = FeOH + + OH ‒ (I ступень)
FeOH + = Fe 2+ + OH ‒ (II ступень)
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь
Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт
Физические свойства щелочей
Гидроксиды щелочных металлов (металлов IА-группы) – твердые бесцветные кристаллические вещества. Как уже было описано выше, большинство из них очень хорошо растворимы в воде. Гидроксиды щелочноземельных металлов хуже растворяются в воде.
Химические свойства щелочей
Основные свойства гидроксидов в Периодической системе возрастают справа налево и сверху вниз. Поэтому все щелочи, образованные металлами IА-группы сильнее щелочей, образованных металлами IIА-группы.
Щелочи окрашивают фенолфталеин в малиновый цвет.
Твёрдые щелочи и их концентрированные растворы разъедают живые ткани, поэтому работать с ними нужно в перчатках, а при растирании твёрдой щелочи в ступке необходимо надевать очки.
- Щелочи реагируют с кислотными оксидами, образуя либо соль и воду, либо кислую соль:
Щелочь + кислотный оксид = соль + вода
Щелочь + кислотный оксид = кислая соль
Рассмотрим эти реакции на примере образования карбонатов и гидрокарбонатов.
Для щелочей, содержащих одновалентный катион (катион в степени окисления «+1») справедлива общая схема реакции:
Для щелочей, содержащих двухвалентный металл (катион в степени окисления «+2») справедлива общая схема реакции:
Металлы IA группы
Какой металл не относится к щелочным?

Найдите отличия галогенов : а) друг от друга б) от щелочных металлов?
Найдите отличия галогенов : а) друг от друга б) от щелочных металлов.
Есть ли у них сходства с щелочными металлами?
Кроссворд по теме «Щелочные металлы»?
Кроссворд по теме «Щелочные металлы».

Строение атомов щелочных металлов?
Строение атомов щелочных металлов.

Щелочной металл , образующий нитрид при н?
Щелочной металл , образующий нитрид при н.
У. : А) K Б) Ca В) Li Г) Na.

Заполните таблицу «Окрашивание пламени ионами щелочных металлов»?
Заполните таблицу «Окрашивание пламени ионами щелочных металлов».
Li + , Na + , K + цвет пламени, примечание.
Щелочные металлы — это?
Щелочные металлы — это?
Составить характеристику щелочным металлам?
Составить характеристику щелочным металлам.

Какие химические элементы относятся к : щелочным металлам, щелочно — земельным металлам, галогенам, благородным газам?
Какие химические элементы относятся к : щелочным металлам, щелочно — земельным металлам, галогенам, благородным газам?
ВЫСШИЙ ГИДРОКСИД ЩЕЛОЧНЫХ МЕТАЛЛОВ?
ВЫСШИЙ ГИДРОКСИД ЩЕЛОЧНЫХ МЕТАЛЛОВ.
Можно ли хранить щелочные металлы под слоем воды ?
Можно ли хранить щелочные металлы под слоем воды ?
Вы находитесь на странице вопроса Какой металл не относится к щелочным? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 10 — 11 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.
1. дано N(NH3) = 4. 816 * 10 ^ 23 — — — — — — — — — — — — — — — — — — — — — — — — — — — — — V(NH3) — ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..

Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.

Дано W(O) = 47 % — — — — — — — — — — — — — — — — E — ? Е — это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 — это алюминий Al2O3 ответ алюминий.

Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.

Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.

Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Читайте также:
- Выбор ножовка по металлу
- Как устроен плазморез по металлу схема
- Сходства металлов и неметаллов
- Из чего делают резцы по металлу
- Межотраслевые правила по охране труда при холодной обработке металлов в рб








